变构药物设计克服蛋白相互作用的“难靶”困境(下)
针对蛋白质相互作用(PPIs)类靶标界面来设计药物被一直认为是“难以成药的”,主要因为传统的方法主张直接靶向蛋白相互作用界面,但是由于大部分蛋白相互作用界面大而平,缺少合适的小分子结合口袋,所以这一类靶标的创新药物研发屡屡受阻。相比于蛋白相互作用界面的物理缺陷,具有更大多样性的变构位点更加有利于小分子调节剂的设计与开发。变构效应长期以来都被应用于调节正构效应难以靶向的药物靶标,近年来,它被逐步应用到蛋白相互作用的调节当中。通过变构效应调节蛋白相互作用已经成为创新药物研发领域的热点。这次我们将和大家分享一下过去几年中,利用变构效应进行蛋白相互作用抑制剂/激动剂研发的经典工作。
一、抑制蛋白质相互作用的抑制剂
A. Runx1−CBFβ
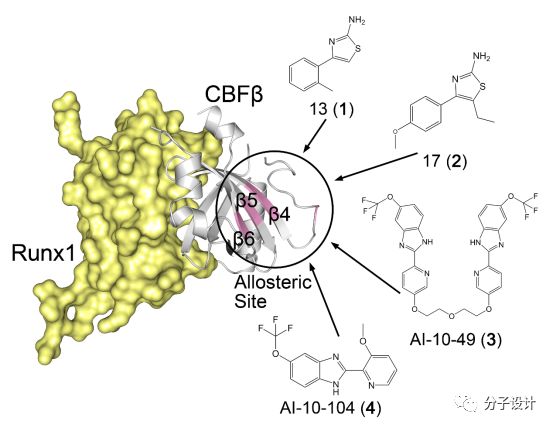
Runx1−CBFβ是一组转录因子,它们的相互作用在包括神经元,造血干细胞等的发育过程当中起到关键性的作用。同时,它们也在包括白血病在内的一系列癌症的发病过程中扮演了重要的角色。CBFβ中的易位会形成融合蛋白CBFβ-SMMHC,它能够异常地和Runx1紧密结合,参与急性淋巴系白血病(ALL)的发病过程当中,因此,Runx1−CBFβ相互作用被认为是癌症治疗的一大重要靶标。
Gorczynski等人最先报道了一系列能够以较高活性抑制Runx1和CBFβ的相互作用的小分子调节剂。研究者首先是利用溶液核磁共振(NMR)解析出CBFβ的晶体结构,随后,通过经典的丙氨酸突变实验以及化学位移分析,他们进一步地确定了Runx1和CBFβ之间地相互作用界面。基于上述的蛋白质结构,研究者对于近70000个化合物首先进行了虚拟筛选,其中获得的35个可能的备选化合物则通过NMR实验进行了进一步的验证。在上述的筛选的结果当中,一共发现了5个IC50低于10μM的化合物,而其中,13(1)和17(2)的IC50更是分别低至1.1及3.2μM。由于调节剂结合状态下的蛋白质结构无法被解析得到,因此研究者直接根据NMR的实验结果对筛选得到化合物进行对接,对接结果显示,上述的化合物结合在有别于Runx1和CBFβ相互作用界面的一个全新的结合口袋。该口袋由CBFβ中的β4-β6折叠结构以及连接β3和β4的茎环结构构成,并且该口袋不会和Runx1的蛋白质相互作用界面有重合,这样说明了上述发现的小分子是通过变构效应对于蛋白质相互作用实现抑制作用的。通过进一步的优化,研究者发现了AI-10-49(3)以及AI-10-104(4)两个活性更好的抑制剂分子。上述这些抑制剂分子通过影响Runx1和CBFβ相互作用的热点残基的动态结构,因而改变二者的相互作用界面,进而实现对于蛋白质相互作用的调控。因此,本案例的成功说明了变构小分子将会是调节Runx1和CBFβ相互作用的有效的工具,并且也能够为以后相关的靶向转录因子的抗癌药物开发提供新的思路。
B. Ras−Effector (Ras和效应蛋白之间的相互作用)
Ras是一个小GTP酶,它在细胞中介导一系列复杂的信号通路。通过在GDP结合的失活状态和GTP结合的激活状态之间转换,Ras能够在细胞信号中扮演一个开关的角色。Ras能参与到包括细胞生长,增殖以及分化在内的一系列细胞活动当中;同时,在超过30%的癌症当中,都会发生Ras蛋白的突变。Ras的功能主要依赖于它和包括Raf,SOS以及PI3K等相关的效应蛋白之间的相互作用。由于Ras蛋白的催化位点对于底物GTP或GDP有着极高的亲和力,同时蛋白表面比较平坦,缺乏小分子结合口袋,因此,Ras长期以来被认为是一个不可成药的靶标。而最近的研究成果则显示,通过变构效应调节Ras和它的效应蛋白之间的相互作用,将有可能是靶向Ras的药物开发既富有发展前景的新方向。
单体蛋白是一种基于III型纤粘蛋白(FN3)骨架合成结合蛋白,它与抗体的功能类似,能够特异并高效地结合到相应靶点。单体蛋白与传统抗体相比,还有着更小的分子量以及更明确的结构,同时,它们在氧化/还原条件下的稳定性也更高,因此,它们被认为是新一类理想的抑制剂分子。
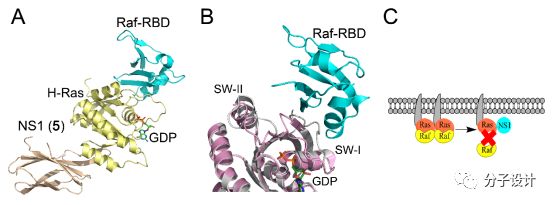
最近Spencer-Smith等人报道了一个新型的变构单体抑制剂,它通过靶向Ras和Raf之间的蛋白质相互作用而起效。研究者首先基于一组单体蛋白库针对Ras蛋白展开实验,从中他们发现了一个只能特异性结合H-Ras不能结合N-Ras的单体蛋白NS1(5)。5和H-Ras的共晶显示,该分子的结合位点位于Ras与Raf相互作用界面的对面,在Ras蛋白中的α4,α5以及β6区域。5结合的时候能够变构地引起SW-I和SW-II结构域的构像变化,从而扰动Ras和包括Raf在内的效应蛋白之间的相互作用。电子显微镜分析,BRET实验以及免疫共沉淀实验均表明Ras和Raf的相互作用会被5破坏。进一步的细胞实验则证明,5能够有效地抑制细胞内Ras蛋白下游的MAPK信号通路的激活。膀胱癌癌细胞中的实验则显示5能够抑制内源性突变的Ras信号以及相应引起的细胞增殖。上述的这些结果都表明,通过变构效应破坏Ras和Raf之间的蛋白质相互作用能够抑制Ras蛋白介导的细胞癌变,这也为靶向Ras蛋白的抗癌疗法开发提供新的思路。
C. eIF4E—eIF4G
在真核细胞中,蛋白质翻译的起始需要一系列起始因子(initiation factors, eIFs)的共同作用,而其中,最重要的是eIF4E和eIF4G。eIF4E和eIF4G的异常增强的相互作用会导致癌症当中癌细胞内部不受调控的增殖以及生存信号。因此,二者间的相互作用被认为是未来抗癌药物的一大重要靶标。
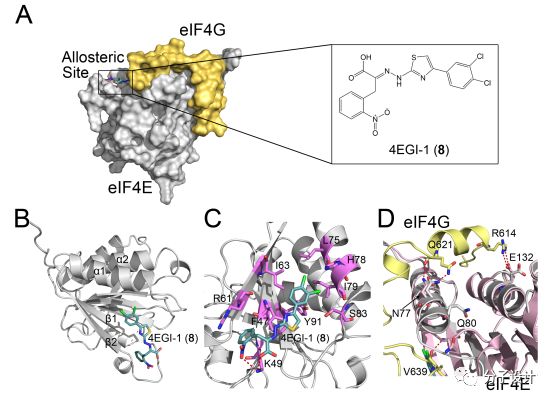
此前针对eIF4E和eIF4G相互作用体系的抑制剂开发主要着眼于一类内源性的eIF4E结合蛋白(4E-BPs)。而为了模拟4E-BP的药物效应,Nathan等人对一个包含近16000个分子的化合物库基于荧光偏振实验(fluorescence polarization-binding assay)进行了高通量筛选,并发现了其中一个有活性的抑制剂4EGI-1(8)。Papadopoulos等人通过NMR实验,解析出eIF4E和8的蛋白质共晶,晶体结构显示8结合在eIF4E中连接β1 and β2折叠的“帽子结合结茎环”(cap-bindingloop)以及靠近α1螺旋C端结构所形成的口袋当中。X射线晶体结构也证实了小分子会结合到这个疏水口袋当中。通过比较eIF4E分别和eIF4G以及8的共晶,研究人员发现二者分别结合到不同的位置上,这也说明了8是通过变构效应实现调节作用的。结构比对发现,8结合的时候,eIF4E的蛋白质相互作用界面上的ɑ螺旋(V69-S82)会变得更加规则,从而阻碍eIF4G的结合。此外,结构分析还发现eIF4E上多个相互作用的热点残基(如,N77, Q80, 还有E132)在8结合的时候都会发生构象变化,因而破坏蛋白质相互作用界面上形成的氢键和盐桥。而上述的分子间相互作用的影响也能够一定程度地解释eIF4E和eIF4G之间相互作用被抑制的机理。最近,Nicola等人结合NMR实验以及分子动力学(MD)模拟,进一步地探索8和eIF4E之间地相互作用。他们发现,8并没有完全改变eIF4G在eIF4E上的结合位点的结构,该化合物是通过影响eIF4E蛋白内部的残基相互作用网络,一定程度上地增加了蛋白质相互作用界面的结构柔性,因而施行抑制效应的。8的抑制活性随后在多个癌症细胞系中得以证实,它能够促进癌细胞凋亡,并且能够阻止癌蛋白的表达。考虑到翻译过程在正常生理状态下以及病理状态下都发挥着不可或缺的功能,8不仅能成为一个调控细胞蛋白质翻译的工具分子,还能够作为未来极富前景的一类抗癌药物。
D. LFA-1−ICAM-1
LFA-1又名CD11a/CD18或者αLβ2,是β2整合素家族当中其中一个蛋白质异元二聚体。LFA-1主要通过和免疫球蛋白超家族配体,如ICAM-1, ICAM-2, 及ICAM-3等相互作用发挥功能。LFA-1在T细胞特异性免疫当中扮演着重要角色,它主要参与到T细胞的增殖,黏附以及迁移当中。鉴于LFA-1和ICAM家族之间的蛋白质相互作用对于免疫系统有着重要意义,所以已经有大量的研究试图开发靶向该相互作用的调节剂,以用于包括哮喘在内的与非正常免疫反应相关的疾病。
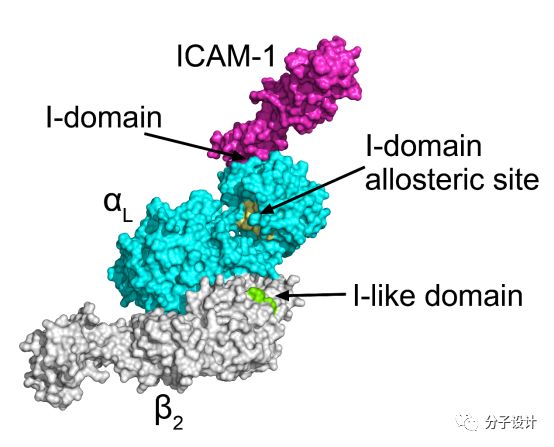
LFA-1包括两个亚基,αL和β2,它主要通过αL亚基上的I结构域和LFA-1发生相互作用。上述的相互作用过程会受到I结构域上的变构位点(I-domainallostericsite,IDAS),或者是的调控β2亚基上的I-like结构域(I-likedomain)的变构调控。由于靶向这两个变构位点的药物分子不需要和高亲和力的蛋白质相互作用配体ICAM-1相互竞争,所以它们具有较高的生物活性,因此被认为是两类具有潜力的靶向LFA-1-ICAM-1相互作用的变构调节剂,并且它们也被逐步应用到抗炎药物的研发当中。
1. αL亚基上的变构位点
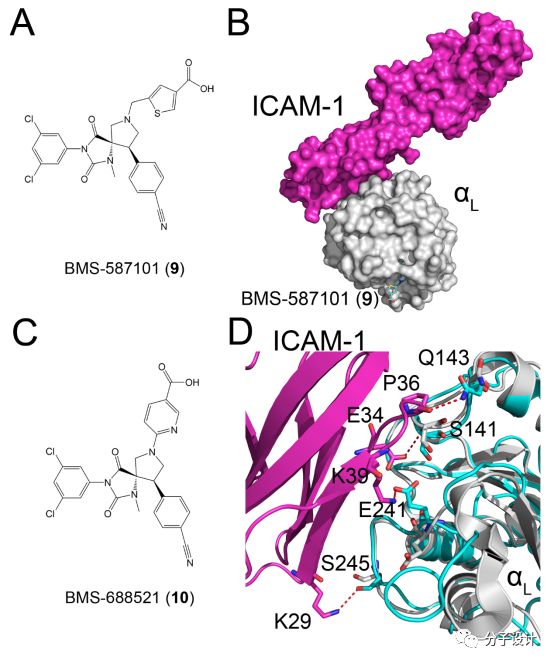
一直以来,很多课题组都尝试通过靶向IDAS来抑制LFA-1和ICAM-1之间的蛋白质相互作用。该研发思路主要是探究潜在的变构调节剂能否将I结构域诱导形成一个关闭的构象,进而阻止ICAM-1的结合。相关的研究当中,最经典的例子是BMS-587101(9)。X射线衍射解析出来的9和LFA-1中的I结构域的共晶显示,该化合物结合到IDAS上面而不会影响到发生蛋白质相互作用的I结构域,这也说明这个化合物是通过变构效应发挥功能的。研究者进一步利用基于人类脐静脉内皮细胞和人类T细胞的细胞黏附实验,验证了9对于LFA-1和ICAM-1之间相互作用介导的细胞黏附的效应。上述的实验显示9的IC50达到20nM。此外,在单向淋巴细胞反应实验中,9也具有很好的活性,IC50达到280nM。考虑到9优越的调节活性,研究者对其进行进一步的构效分析,并且得到更加优化的化合物BMS-688521 (10)。类似的实验同样被用于检验10的化合物活性,在细胞黏附实验和淋巴细胞反应实验中,10分别拥有2.5nM以及60nM的IC50,与9相比有了显著的提高。晶体结构则显示10和9结合在同一个位点上,它们都能够影响由T291-K305组成的ɑ螺旋,使之变得更规则和稳定。同时,晶体学研究还发现,上述的抑制剂结合并没有大规模地改变蛋白质相互作用界面的结构,而是变构地影响相互作用界面上热点残基的构象,进而产生抑制效应。在抑制剂结合的时候,LFA-1上的E241残基的朝向会发生改变,其参与的和ICAM-1上K39残基的相互作用会被破坏。同样的,在LFA-1上的S141, Q143还有S245残基,也会受抑制剂的结合的影响而发生构象改变。因此9和10都能够变构地破坏LFA-1和ICAM-1之间地相互作用。而在一个肺部过敏性嗜酸性粒细胞感染地小鼠模型中,通过使用10能够有效的阻止嗜酸性粒细胞在气道的积累,这说明即使是在体内10对于LFA-1和ICAM-1之间的相互作用的抑制仍然有很好的活性。有鉴于此,10也进入到进一步的临床测试阶段,有望为以后有关免疫炎症反应的药物开发提供更多的可能。
2. β2亚基上的变构位点
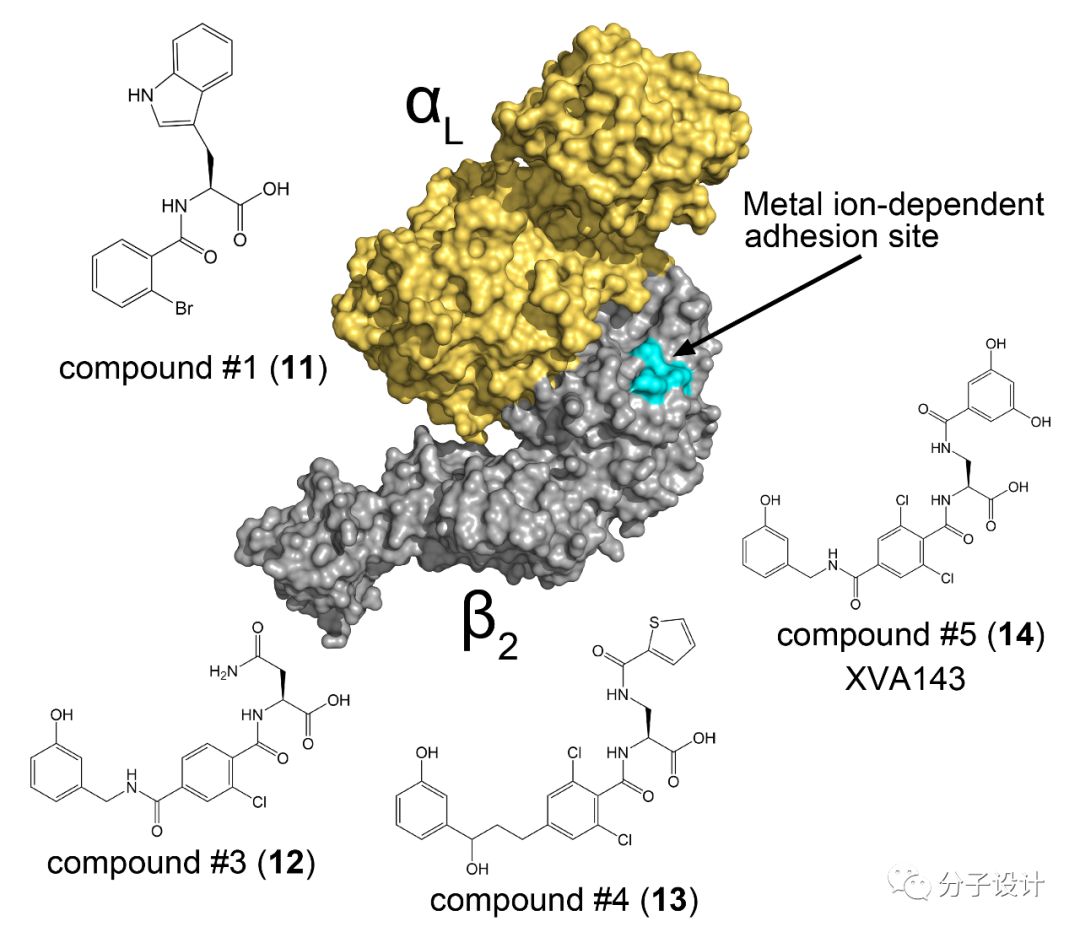
除了IDAS,β2亚基上的I-like结构域上也存在有一个变构口袋。大多数靶向这个口袋的化合物主要来源于大型生物制药公司,如基因泰克公司(Genentech)和罗氏公司(Roche)。这些化合物设计的时候主要是为了模仿ICAM-1在LFA-1上结合是所产生的效应,因此,后续的药物设计和优化主要是基于二者之间相互作用所涉及的残基结构以及功能所展开的。上述的药物开发过程首先合成出compound#1(11),而进一步的构效关系分析则发现了活性更好的化合物,包括compound#3(12),#4(13)以及#5(XVA143)(14)。研究者随后设计出一个LFA-1的突变体用于检验化合物是变构调节剂还是正构调节剂。在这个突变体中,I结构域受突变影响而被固定在长期开发的高亲和力的构象中。由于I结构域介导了LFA-1和ICAM-1之间的相互作用,所以对于这个突变体蛋白,正构抑制剂仍然能够竞争性的抑制蛋白相互作用,而变构抑制剂则无法发挥其抑制效应。通过这样的方法,研究者证实了上述化合物(11-14)是通过变构效应发挥作用的。同时,研究者又对于单独的αL亚基进行了实验,结果发现上述的化合物在这样的条件下并没有抑制活性,因此,可以推断,上述的抑制剂的结合位点是位于β2亚基上的。基于β2亚基上的多个结构域进行的突变实验发现,在金属离子依赖的黏着位点(metal ion-dependent adhesion site, MIDAS)引入的突变能够导致化合物的脱落,这说明上述的化合物是通过该口袋结合到β2亚基上的I-like结构域,进而对于LFA-1和ICAM-1之间的蛋白质相互作用产生抑制效应。
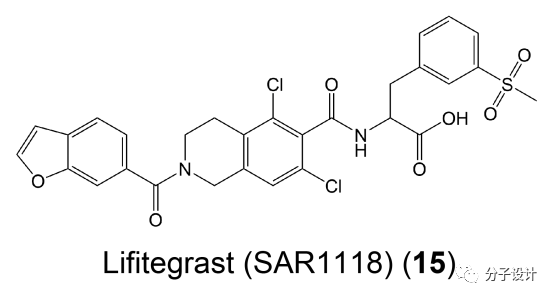
进一步的体内单向淋巴细胞反应实验证实了前文这些化合物在生物体内也会有很好的效果,因此它们也为未来靶向LFA-1和ICAM-1的相互作用治疗免疫疾病指明了另一个新方向。最近,有一个新的抑制LFA-1和ICAM-1相互作用的药物成功上市,而它很大程度上就是利用了上述的变构位点以及相关化合物的抑制效应的。这个新型药物是lifitegrast(SAR118)(15),它被应用到治疗干眼症的滴眼液当中。虽然该药物详细的作用机理尚不明确,但是相关的解释当中,其中一个主要的假说便是这个药物分子结合到I-like结构域上的变构位点发挥作用的。虽然该药物的具体机制仍亟待阐明,但是它的成功应用预示着I-like结构域上的变构口袋将会在未来临床有关免疫疾病的药物研发中拥有着一席之地。
E. Regulator of G Protein Signaling−Gα Protein (G蛋白受体调节蛋白和G蛋白α亚基之间的蛋白质相互作用)
G蛋白偶联受体(GPCR)是一类膜蛋白,它们会参与到一系列重要的细胞信号当中。G蛋白是GPCR最主要的效应蛋白,它包括α- 和βγ-两部分亚基。对于GPCR信号的调节主要是依赖于G蛋白信号调节蛋白(regulators of G protein signaling, RGS)实现的。RGS主要能够结合到G蛋白的α亚基上,抑制下游相关的信号通路。GPCR涉及很多的细胞过程,因此也参与到众多的疾病发展过程中,所以一直以来都是一类极具有潜力的药物靶点。此外,和GPCR紧密相关的RGS也因为它们对于GPCR的调节作用,也在药物研发行业吸引着各方的关注。同时,由于RGS具有组织特异性等特点,因此靶向RGS的药物开发往往能够有更好的选择性,而针对RGS和它们所涉及的和G蛋白等之间的相互作用也同样是药物研发的一大方向。通过变构调节剂靶向RGS和G蛋白α亚基之间的相互作用是针对RGS药物开发的典型例子,而其中,最新的案例是一个针对RGS4和G蛋白α亚基相互作用的抑制剂CCG-50014(16)。
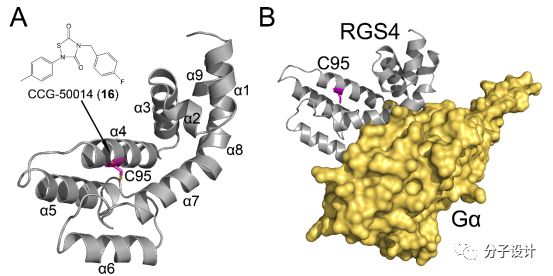
RGS4是RGS蛋白家族里面结构上最简单的一个蛋白,它包含有一个供G蛋白α亚基结合的A位点以及一个变构位点,B位点。RGS4在精神分裂症以及对于鸦片类药物的耐受过程中都发挥着作用。以往的研究发现,通过常规的生化实验来检测RGS的蛋白活性比较麻烦,并不适用于大规模的高通量筛选。为此Roman等人开发出一种基于流式细胞术的蛋白质相互作用检验方法(flowcytometry protein interaction assay, FCPIA),并利用它来对RGS4进行了高通量化合物筛选,最终识别出抑制RGS4和G蛋白α亚基相互作用的化合物CCG-50014(16)。随后,经过温度加速分子动力学模拟(temperature-accelerated molecular dynamics simulation, TAMD simulation)以及NMR实验,研究者们揭示了16通过共价修饰结合到了RGS4的C95残基上。在化合物结合的过程中,它首先会将位点附近的α5-α6螺旋结构挤开,暴露出原本埋在蛋白内部的C95残基侧链,随后再进行进一步的共价结合反应。动力学模拟以及NMR和相关的化学位移(chemical shift perturbation, CSP)实验分析也显示,16能够在α4-α7的螺旋结构施加空间位阻效应,进而限制α5-α6螺旋结构的闭合,并且小分子也能够变构地影响RGS4和G蛋白α亚基结合界面的稳定性,最终抑制二者的相互作用。
考虑到RGS和相关的蛋白质相互作用在GPCR等信号通路中的重要角色,靶向该过程的药物研究一直不断有新的成功的例子涌现。上述案例中所报道的生化活性良好的共价变构蛋白质相互总用抑制剂同样也是为未来相关的药物开发提供一个宝贵的思路。此外,16的共价结合模式同样也能够为它带来更长的体内药物半衰期,更高的靶点准确性等优势。但同时,共价配体同样也可能因为其具有反应活性的化合物封端而导致毒性及副作用的产生。因此,上述这些共价调节剂的性质和特征,一方面说明了共价结合模式在变构蛋白质相互作用调节剂开发当中的巨大应用潜力,另一方面也强调了,在该领域未来仍需要有更多的研究与发展来解决现有的一系列的问题。
F. iNOS Dimerization
一氧化氮(NO)是一个重要的细胞内信号分子,它会参与到心血管疾病,阿尔兹海默症等一系列疾病过程之中。一氧化氮合成酶(NOS)主要参与细胞内的NO生物合成,因此也成为了一个潜在的药物靶点。在人体内,NOS家族包含3个亚型,分别是诱导型NOS(iNOS),神经型NOS(nNOS)以及内皮型NOS(eNOS)。这三种NOS亚型分别会和炎症及自身免疫病;中风和帕金森病;还有血管内稳态有关。NOS主要需要二聚体化来发挥功能,两个NOS相互结合之后,能够介导精氨酸氧化为NO和瓜氨酸过程中的电子转移。因此通过变构蛋白质相互作用抑制剂来破坏iNOS的二聚化已经成为治疗iNOS参与的包括脓毒性休克,类风湿性关节炎等疾病的有潜力的疗法。
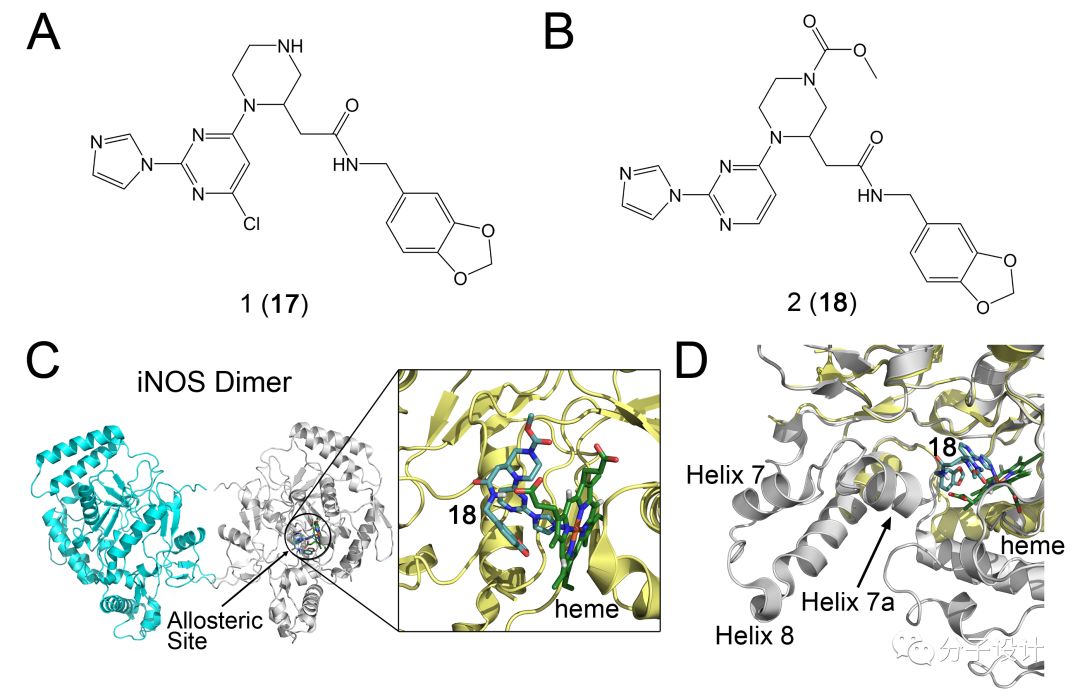
针对iNOS,研究者最开始是通过组合化学的方法来进行药物开发的。他们首先基于一个母核(pyrimidineimidazole core)进行结构改造,随后基于改造得到的化合物进行大规模的筛选。筛选的结果找到了两个活性较好的化合物1(17)和2(18),而基于其中的18,研究者们对于它的生物活性以及生化性质等进行了进一步的实验分析。在RAW 264.7细胞系中,18能够抑制iNOS介导的NO生物合成,并且在细胞内也能够观测到单体iNOS的堆积,这都说明了18能够有效地抑制iNOS的二聚化。晶体学的研究则发现18结合在iNOS上远离蛋白质相互作用界面的精氨酸结合口袋,这也说明了18主要是通过变构效应来实现抑制作用的。在结合的过程中,18会直接和iNOS中的血红素发生配位作用,同时还会诱导螺旋7的构象变化,使之变得更不规则。此外,螺旋8以及附近的残基的构象也会因为18的结合而改变,最终影响到iNOS二聚体的相互作用界面。随后,利用BSC-1细胞系,研究者们进一步探索了18针对不同NOS亚型的选择性。他们发现,18对于另外两种NOS,eNOS和nNOS的IC50都比iNOS的要高很多,这说明了在细胞内,18能够特异性的抑制iNOS的二聚化。综上所述,鉴于18良好的抑制活性以及选择性,它有望为以后靶向iNOS二聚化的变构抑制剂药物的开发打好基础。
二、稳定蛋白质相互作用的变构调节剂
大部分变构调节剂都是设计来抑制或者破坏蛋白质相互作用的。但是,在很多生理条件下,我们同样需要增强和延长蛋白质相互作用的过程,而这也说明了开发能够稳定蛋白质相互作用的调节剂同样在药物设计领域有着广阔的发展空间。而其实在自然界,我们已经能找到一系列的通过变构效应来稳定蛋白质相互作用的调节剂的例子,其中,最经典的莫过于从红豆杉中提取的紫杉醇,它甚至已经作为一种微管蛋白的相互作用的变构增强剂被应用到临床癌症治疗当中。
微管蛋白的相互作用
微管是一个重要的细胞内机械结构,它会形成细胞骨架,参与到细胞周期,细胞内物质运输等活动当中。微管是由13条原丝(protofilament)组成的圆柱状结构,而每条原丝又是由一系列的α-和β-微管蛋白构成的。微管蛋白之间的蛋白质相互作用介导了微管网络的动态变化,而该过程也在包括癌症发生在内等一系列生物过程中发挥着重要功能。因此,能够稳定微管蛋白之间的相互作用的微管稳定剂(microtubule-stabilizing agents, MSAs),由于它们能够通过促进微管结构的稳定性而阻止异常的细胞分裂并诱导凋亡,所以已经成为抗癌药物研发的热门方向。到目前为止,已经有一系列的MSA被应用到临床,其中紫杉醇/特素(19)(paclitaxel/Taxol)是首个被FDA批准的MSA化疗药物,它能够变构地稳定微管蛋白之间的相互作用,最终杀死癌细胞。虽然19在临床上已经被广泛应用于治疗乳腺癌以及非小细胞肺癌,但是它具体的稳定蛋白质相互作用的机制仍不明确。Alushin等人曾经通过冷冻电镜的研究提出,19会结合到一个远离微管蛋白相互作用界面的变构位点,然后通过影响微管蛋白之间的作用界面以及整条原丝的构象来稳定微管蛋白之间的蛋白相互作用。简而言之,19为未来靶向微管的抗癌药物的研发提供了一个极富有前景的方向,而基于19的结构所产生的一系列衍生物,诸如docetaxel (Taxotere®) (20) 和cabazitaxel (Jevtana®) (21),也被分别应用到头颈癌以及膀胱癌的治疗当中。
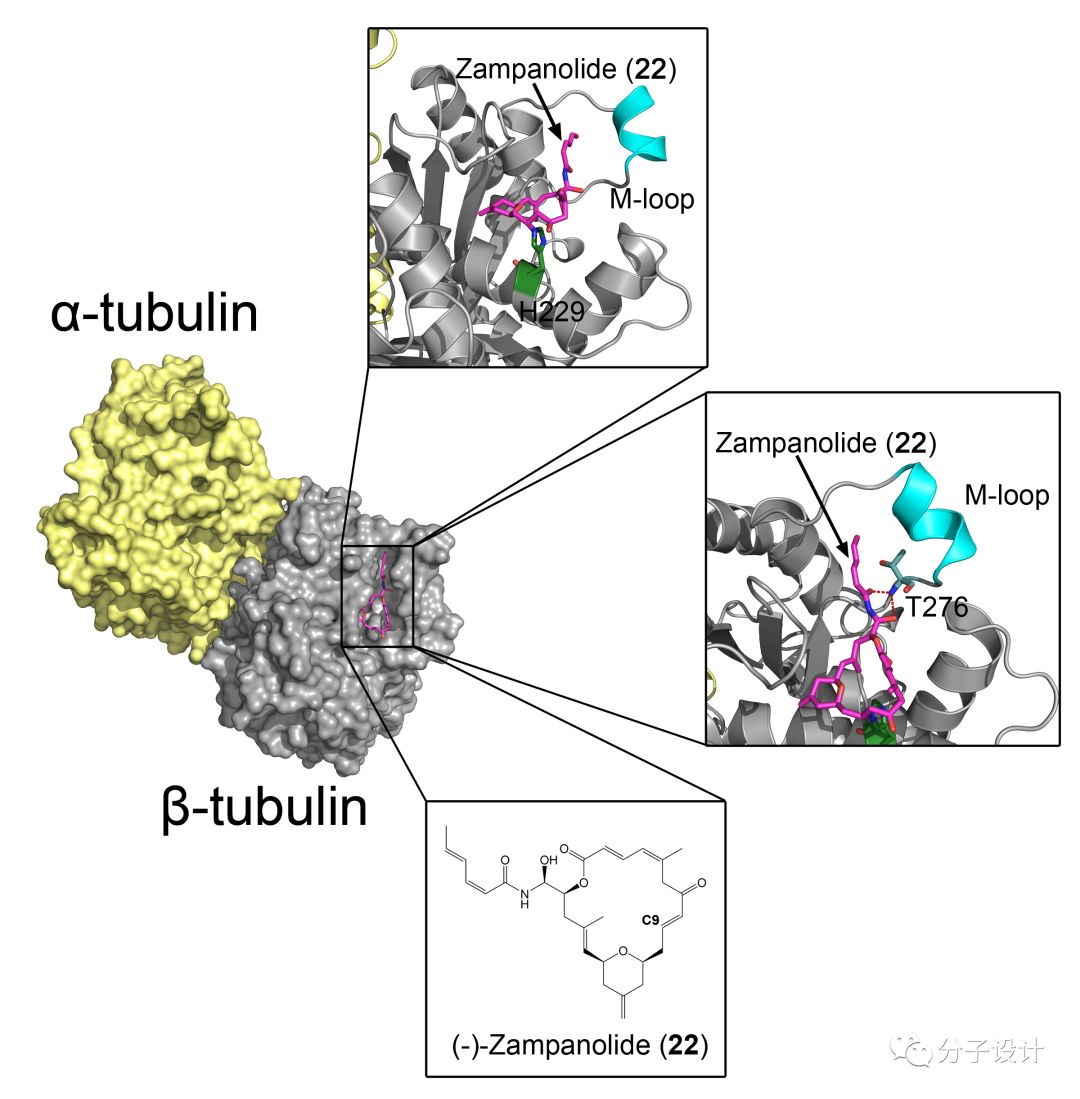
最新的有关19的结合位点的研究和应用是对于zampanolide(22)的报道。22是一个从汤加海绵Fasciospongia rimosa中分离出来的20元环化合物,它能够通过稳定微管结构来阻止细胞的有丝分裂,抑制细胞增殖。Andrea等人发现,22和19结合到同一个位点,并且都可以变构地稳定微管蛋白之间的相互作用。而通过晶体学的研究,他们发现22通过C9原子共价地结合到β-微管蛋白中H229残基当中地NE2原子上,并且在分子结合地过程中,它会诱导邻近地结构发生变化。22会和β-微管蛋白中T276残基形成氢键相互作用,同时它还能够诱导结合位点附近的由残基R278到Y283构成的M茎环结构(M-loop)从无规则结构转变为一段短的螺旋片段,经历过构象转变后的M茎环结构会进一步插入到邻近的微管蛋白当中,增强彼此间的相互作用。此外,22的结合还能够诱导微管蛋白从不稳定的“弯曲”构型转变为更加稳定的“直”构型,这也能够使相邻的微管蛋白能够更好的结合,形成整条的原丝。所以总而言之,22的结合能够变构地增强微管网络中,横向和纵向的微管蛋白单体之间的相互作用,最终实现稳定微管及细胞骨架地效果。而在多个人类耐药性癌细胞系当中地实验则显示,22对于微管蛋白地相互作用地效果比19更强。考虑到22良好的生化性质以及生物活性,它也必将称为未来极富有前景地MSA类型抗癌药物。
三、总结与展望:
蛋白质相互作用是一系列细胞活动以及生物功能的基础,它们也被誉为是药物开发的圣杯。考虑到它们在生理情况和病理状态下的关键作用,它们必将在未来称为药物研发的主流方向。而目前,随着药物市场的迫切需求的增加以及相应的化学生物学,生物物理学还有结构生物学等领域的进步,靶向蛋白质相互作用的药物开发也逐渐加快了脚步。
传统的蛋白质相互作用调节方法着眼于相互作用界面,但是由于该界面在结构上天然的劣势,所以直接通过小分子靶向蛋白质相互作用界面用于药物开发一直是学界的一大难题。而作为结构生物学以及药物开发领域最新的突破,变构蛋白质相互作用抑制剂很有希望为直接靶向蛋白质相互作用界面的正构调节剂提供补充,并且还能够有效地改善相关药物的理化性质以及生物活性。到目前为止,已经有多个变构蛋白质相互作用调节剂被应用到临床治疗当中,其中最典型的例子便是靶向微管蛋白相互作用的紫杉醇(19)及相关的衍生物。但是变构调节剂依然存在一系列诸如药物动力学性质较差等的问题。变构蛋白质相互作用药物开发过程中最大的一个挑战便是难以进行合理的药物设计与优化。虽然目前我们已经深入了解了不少的有关蛋白质变构效应的机理机制,但是我们在这个领域上的探索仍然只是处于初步阶段。因此,现时大部分的变构蛋白质相互作用调节剂的开发都是比较随机的,因而也影响了进一步的药物改造与优化。
解决上述困难的其中一个潜在方法便是发展变构药物设计工具。在变构位点的预测与识别的领域,现在已经由一系列的理论模型或者算法被提出和应用,比如AlloSite所应用的基于结构的模型,PARS所应用的基于简正模分析(normal mode analysis)的模型,还有STRESS应用的基于拓扑学和图论的模型。此外,最新的研究成果,比如能够定量的分析变构信号传递所涉及的能量变化的AlloSigMA,还有能够进行变构组学分析和虚拟筛选的AlloFinder,它们都能够为日后蛋白质相互作用的变构药物开发提供有力的指导。因此,变构药物设计方法预测变构位点的手段将很有希望为日后有关蛋白质相互作用的变构药物开发提供前期基础,指导后续的药物优化。
另外,由于传统变构调节剂靶向的是蛋白质的活性位点,而蛋白质相互作用变构调节剂靶向的是蛋白质相互作用界面,二者的调节靶标不同,因此它们也不能完全一视同仁。蛋白质的活性位点相比于蛋白质相互作用界面来说结构上更简单更明确,所以通过变构效应来调节蛋白质相互作用界面可能会比调节蛋白质的活性位点更加困难。虽然前文中我们已经总结了一系列有关变构位点预测和识别的最新研究进展,但是在未来,我们也许还需要研发出专门针对蛋白质相互作用体系的变构位点预测方法。我们认为,对于不同的蛋白质相互作用体系,我们应该开发应用不同的药物设计模型。比如说对于作用界面会在相互作用过程当中有明显变化的体系,基于结构以及基于拓扑学和图论的计算模型将会有极大的用武之地;而对于好像LFA-1-ICAM-1这样的,相互作用界面在蛋白质结合过程中并没有很大变化的体系,我们设计算法的时候可能还需要更多的考虑到蛋白质结构的动态变化。
总之,利用变构效应进行药物开发长期以来就被应用到靶向一些传统正构药物难以发挥作用的靶标,如GPCR和蛋白激酶等。而在后基因组时代,蛋白质相互作用正在吸引着越来越多的注意,并且也成为了药物开发与临床治疗应用都紧密联系的重要领域。靶向远离蛋白质相互作用界面的变构口袋进行变构药物开发,能够为未来的药物设计提供更广阔的空间,同时它还能赋予相应的小分子相比于正构药物更大的发展空间和更好的药物效果。考虑到上述这一系列的优点,我们有理由相信,变构调节剂将有望成为蛋白质相互作用药物开发领域未来的一大热门方向,为靶向蛋白质相互作用的药物开发所遇到的问题提供一个更优化的解决方案。
1. Ni D, Lu S, Zhang J. Emerging roles of allosteric modulators in regulation of Protein-Protein Interactions (PPIs): new paradigm for PPI drug discovery. Med Res Rev. 2019, doi: 10.1002/med.21585.
版
权
声
明
本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。 返回搜狐,查看更多
责任编辑: