PPARγ 在自身免疫性疾病中的研究进展
PPARγ 在自身免疫性疾病中的研究进展
来源
《药学学报》2022, 57(10): 3124 −3132
作者
杨艳, 周禹, 隗雅姿, 张天泰
中国医学科学院、北京协和医学院药物研究所
摘要
自身免疫性疾病(autoimmune diseases, AID) 是由于自身免疫系统攻击自身组织产生的疾病。研究表明,自身免疫耐受的失衡及长期炎症反应无疑是AID发生的核心事件。过氧化物酶体增殖物激活受体γ (peroxisome proliferator-activated receptor γ, PPARγ) 属于核激素受体超家族, 是配体激活转录因子。PPARγ 与维甲酸X 受体(retinoid X receptor, RXR) 结合形成异源二聚体; 当PPAR被激活后, 该复合体通过与位于每个基因调控位点的特定的过氧化物酶体增殖物反应元件(PPAR response element, PPRE) 结合, 进而发挥调控基因表达的作用。PPARγ 具有多种生物学功能, 在调节新陈代谢、控制炎症、调节糖脂代谢、改善动脉粥样硬化、抑制肿瘤和调节免疫过程中发挥重要作用。
近几年研究表明, PPARγ 参与多种AID的发病机制, 其可能涉及调节巨噬细胞的激活和极化, 调控树突状细胞功能, 介导T细胞的增殖和分化及调节相关基质细胞的功能。
本文就PPARγ 的生物学功能、信号转导途径和激动剂对AID的保护作用及相关机制进行总结, 旨在为相关疾病的机制研究和防治策略提供依据。
关键词
过氧化物酶体增殖物激活受体γ; 激动剂; 自身免疫性疾病; 免疫调节; T细胞; 巨噬细胞
| _ | 正文 | _ |
自身免疫性疾病(autoimmune diseases, AID) 是由于自身免疫系统攻击自身组织产生的疾病, 全球发病率大约3%~5%。其病理机制尚不明确, 但与环境因素(生活方式、饮食、药物和感染) 及遗传等有关[1], 常见的自身免疫性疾病有类风湿性关节炎(rheumatoid arthritis, RA)、炎症性肠病(inflammatory bowel disease, IBD)、系统性红斑狼疮(systemic lupus erythematosus, SLE)、多发性硬化(multiple sclerosis, MS)、系统性硬化(systemic sclerosis, SSc)、干燥综合征(sjogren's syndrome, SS) 和自身免疫性甲状腺疾病(autoimmune thyroid disease, AITD) 等。
据报道, 自身免疫耐受的失衡及长期炎症反应无疑是AID发生的核心事件。过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptors, PPAR) 参与多种涉及免疫系统调节的细胞(单核细胞/巨噬细胞、树突细胞和淋巴细胞) 的成熟和功能调节。因此, 以此为靶点研发AID的治疗药物具有重要的科学意义。
1
PPARγ 的结构与生物学功能
1.1 PPARγ 的结构
PPAR 属于核激素受体超家族,是配体激活转录因子。其存在3 种由不同的基因编码的亚型, 即PPARα、PPARβ/δ 和PPARγ。PPAR 与维甲酸X 受体(retinoid X receptor, RXR) 结合形成异源二聚体。当PPAR 被激活后, 该复合体通过与位于每个基因调控位点的特定的过氧化物酶体增殖物反应元件(PPAR response element, PPRE) 结合, 进而发挥调控基因表达的作用[2]。尽管上述3 种PPAR 亚型在结构上高度相似, 但它们的配体及分布模式均存在显著的差异。目前, PPARγ 亚型最受学者关注。PPARγ 包含9 个外显子, 通过启动不同启动子和选择性剪接产生多种PPARG 剪接变体。PPARG1、PPARG3 和PPARG4 编码PPARγ1 亚型, 主要表达于脂肪细胞、上皮细胞、单核/巨噬细胞、树突细胞和T 淋巴细胞。
PPARG2 编码PPARγ2 亚型, 主要表达于脂肪细胞、膀胱上皮细胞和T 淋巴细胞。PPARg2Δ5 亚型内源表达于脂肪组织, 由于外显子5 跳跃突变缺乏整个配体结合区, 其表达水平与超重、肥胖或2 型糖尿病患者体重质量指数呈正相关。其机制可能为PPARg2Δ5 虽然缺乏配体结合区, 但仍保留结合RXRα 的能力, 影响PPARγ 转录激活, 影响与代谢有关的基因的表达, 抑制脂肪前体细胞分化为成熟脂肪细胞[3]。
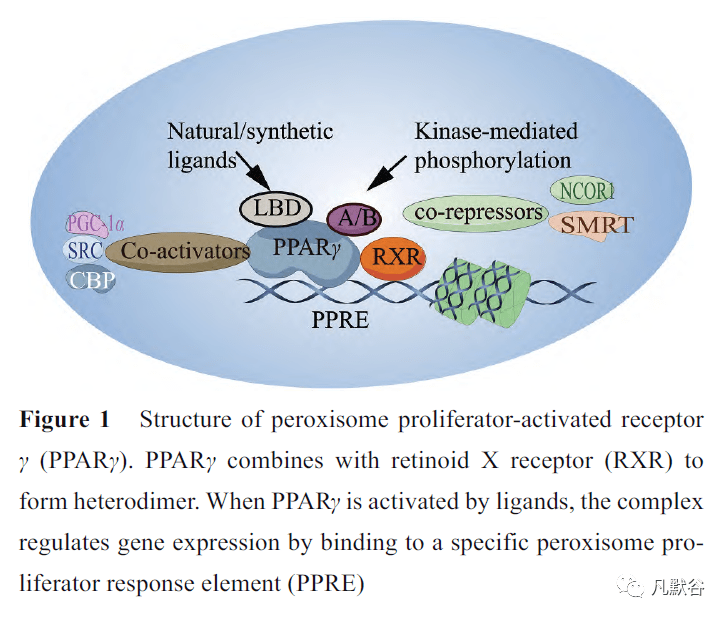
除此之外, PPARγ 也可通过蛋白质翻译后修饰如磷酸化、乙酰化、O-乙酰葡糖胺糖基化和泛素化等调节其下游基因的转录。PPARγ发生蛋白质修饰后, 蛋白构象改变, 调节蛋白质相互作用, 改变受体和配体之间的亲和力[7]。
1.2 PPARγ 的生物学功能
PPARγ 具有多种生物学功能, 在调节新陈代谢、控制炎症、改善动脉粥样硬化、抑制肿瘤和调节免疫过程中发挥重要作用。据报道,PPARγ 可调节机体糖脂代谢稳态, 目前PPARγ 已成为治疗2 型糖尿病的重要靶点[8]。PPARγ 激动剂可增加组织对胰岛素的敏感性, 改善胰岛素抵抗, 降低血糖,促进脂肪细胞分化和减少脂质沉积。PPARγ 调控与脂肪代谢相关的转运蛋白和脂肪酶的表达[9,10]。此外, PPARγ 还被证实是参与过敏性哮喘的多种细胞的重要调节因子。气道上皮细胞(airway epithelial cells, AECs) 中可见PPARγ 表达, PPARγ 激动剂通过抑制TNF-α 和基质金属蛋白酶9 (matrix metalloproteinase 9, MMP-9) 的表达调节AECs 细胞功能; 降低黏附分子血管细胞黏附分子-1 (vascular adhesion molecule 1, VCAM-1) 和细胞内细胞黏附分子-1 (intracellular adhesion molecule-1, ICAM-1) 及趋化因子CCL5 和嗜酸性粒细胞趋化因子的表达, 抑制黏蛋白5AC基因转录抑制气道黏液来缓解过敏反应。此外, AECs 特异性敲除PPARγ 的小鼠哮喘加重; 在PPARγ 敲除的AECs中, NF-κB 信号通路过度活化, IL-25、IL-33 和胸腺基质淋巴细胞生成素释放增加。
PPARγ 激动剂负性调节粒细胞的功能, 诱导中性粒细胞凋亡, 降低CD69 表达, 抑制嗜酸性粒细胞衍生的神经毒素释放; 对Th2 型细胞因子IL-4 水平没有影响, 但显著抑制IL-5 和IL-13的分泌[11]。据报道, PPARγ 还参与动脉粥样硬化的发生发展。PPARγ 通过调节细胞黏附分子(如VCAM-1和ICAM-1) 的表达, 抑制内皮细胞活化; 减少单核细胞趋化蛋白1、MMP-9 和金属肽酶抑制剂1 的产生, 抑制单核细胞跨内皮细胞迁移; 激活PPARγ -LXRα -ABCA1 信号通路, 加速巨噬细胞胆固醇外流, 抑制泡沫细胞形成[12]; 改善心血管细胞的炎症反应, 抑制斑块的形成, 保持斑块的稳定性; 抑制Toll 样受体4 (Tolllike receptor 4, TLR4) 介导的炎症来抑制血管平滑肌细胞的增殖和迁移, 最终减轻颈动脉损伤后的内膜增生[13]。除此之外, PPARγ 对肿瘤的发生发展同样具有重要的调控作用, 激活的PPARγ 可通过抑制Wnt/β - catenin、PI3K/Akt、信号转导和转录激活因子(signal transducers and activators of transduction, STAT) 和NF-κB 等信号转导途径及调节脑和肌肉芳烃受体类核转位蛋白1 等关键的昼夜节律基因来抑制肿瘤进展[14]。PPARγ 还能够改变辅助性T 细胞(T helper, Th) 1/Th2和Th17 的平衡, 以及调节巨噬细胞和树突状细胞的反应和表型, 改善AID。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果, 注明【来源:凡默谷公众号】。
2
PPARγ 配体
PPARγ 配体包括内源性配体和外源性配体。常见的PPARγ 天然/内源性配体有15-脱氧-Δ12,14-前列腺素J2 (15d-PGJ2) 和多不饱和脂肪酸等。外源性配体为PPARγ的人工合成配体, 包括以下4个亚类: ① 噻唑烷二酮家族(thiazolidinedione, TZD) 如罗格列酮、吡格列酮和曲格列酮; ② 选择性PPARγ 调节剂(selective PPARγ modulators, SPPARMs), 如部分PPARγ 激动剂、PPARγ磷酸化抑制剂和TZDs衍生物[15]; ③ 双重PPARα/γ 激动剂如莫格列扎和阿格列扎; ④ 泛PPARγ 激动剂(PPARα/δ/γ 激动剂) 如lanifibranor 和chiglitazar[16]。
3
PPARγ 及其激动剂在自身免疫性疾病中的作用
3.1 PPARγ 与RA
RA是一种以对称性、多关节炎为特征的全身性自身免疫性疾病, 在全球的患病率高达1%[17], 其中女性患病率高于男性, 其致病过程可能与基因、环境因素和表观遗传学有关, 其主要特点为炎性细胞浸润、血管翳形成, 软骨和骨侵蚀, 最终导致关节严重畸形甚至活动功能丧失, 具有极高的致残率; 此外, RA病情迁延不愈, 极易反复, 其复发和高疾病活动度时心血管疾病、神经系统疾病风险显著增加; 给患者带来巨大的痛苦和严重的经济负担[18]。据报道, RA患者巨噬细胞中PPARγ 的表达高于健康受试者, 且患者滑膜组织中PPARγ 蛋白和mRNA表达水平与RA疾病活动评分(disease activity score, DAS28) 呈负相关。除此之外, 在全身性自身免疫性疾病中, PPARγ 激动剂也可对心血管系统、关节或肾脏等靶器官起到保护作用。
目前已有临床研究结果显示, 服用吡格列酮的RA患者在疾病活动度、胰岛素抵抗、血管功能和降低C反应蛋白(C-reactive protein, CRP) 水平方面均得到了显著改善, 且安全性较好[19]。此外, PPARγ的天然配体15d-PGJ2通过降低NF-κB受体激活剂配体(receptor activator of NF-κB ligand, RANKL) 诱导的单核细胞趋化蛋白1、破骨细胞相关联的活化T 细胞核因子1 蛋白、c-fos、p65 和c-Jun 的表达, 减少破骨细胞分化, 抑制骨重吸收,促进骨髓脂肪生成, 抑制成骨细胞增生, 抑制骨代谢, 从而抑制RA[20]。滑膜成纤维细胞(synovial fibroblasts, FLS) 和巨噬细胞在RA 发生发展过程中起着关键作用, PPARγ 在此两种细胞中均有表达。RA患者滑膜中存在FLS 在骨和软骨血管膜中的异常迁移、增殖和激活。巨噬细胞是人体重要的固有免疫细胞之一, 可通过释放多种细胞因子进而活化获得性免疫, 继而参与炎性反应, 维持内环境稳态。巨噬细胞具有一定的可塑性, 根据环境刺激不同, 可以分为经典活化巨噬细胞M1 型和替代活化巨噬细胞M2 型。M1 型巨噬细胞参与各类病原体的清除, 但是一旦M1 型巨噬细胞产生过多会加重机体炎症。此时, M2 型巨噬细胞数目随之增加, 发挥促进损伤修复、细胞增殖和组织重塑等作用从而消除炎症, 恢复机体平衡。Marder 等[19]通过蛋白质免疫印迹法和免疫组化法发现, RA患者和佐剂诱导的关节炎(adjuvant-induced arthritis, AIA) 大鼠的FLS中PPARγ 的水平显著降低。据报道, 上调PPARγ 表达可显著抑制AIA大鼠FLS 的迁移和增殖。PPARγ 的配体诱导滑膜细胞凋亡, 阻断FLS 中NF-κB 信号通路。
在巨噬细胞中, PPARγ 调节其极化、成熟、表观遗传学和代谢[21]。在LPS 诱导的M1 巨噬细胞中, PPARγ 基因缺失的巨噬细胞上清中IL-6、IL-2、IL-1 和TNF-α (M1型巨噬细胞的标志细胞因子) 水平显著升高[22]。与野生型巨噬细胞相比, PPARγ 条件敲除小鼠骨髓来源的巨噬细胞中, M2 型巨噬细胞的标志物精氨酸酶1(arginase 1, Arg1) 活性显著降低, 提示PPARγ 调控巨噬细胞M2 型极化。此外, PPARγ 活性除受到转录水平调控外, 还受到多种翻译后修饰所调控, 如乙酰化、磷酸化和小类泛素化修饰(small ubiquitin-related modifier materialized, SUMO) 等[23]。实验证实, 在小鼠原代腹腔巨噬细胞、小鼠巨噬细胞系RAW264.7 和小鼠胚胎成纤维细胞中均检测到PPARγ 的内源性SUMO化修饰。
IL-4 刺激巨噬细胞时, PPARγ 第77 位赖氨酸的SUMO化修饰水平显著下调促进Arg1转录, 促进巨噬细胞向M2型极化[24]。此外, mTOR-semaphorin 6D (semaphoring 6D, Sema6D)-PPARγ 轴和PPAR 结合蛋白MED1 也在促进巨噬细胞向M2 型巨噬细胞的极化过程中起着重要作用[25]。抑制mTOR 蛋白或敲除Sema6D 基因使PPARγ 表达减少和脂质代谢重编程受损, 从而抑制巨噬细胞向抗炎表型极化。mTOR激活后上调Sema6D,并与Sema6D胞质区域的SH3 结构域中的富含脯氨酸的区域(PXXP) 的结合位点结合, 随后复合体与参与PPARγ 转录的酪氨酸激酶c-Abl 结合, 促进PPARγ 表达, 从而促进巨噬细胞向M2 型巨噬细胞极化。
除此之外, PPARγ 在T 细胞的分化中亦发挥着重要作用。T 细胞是主要来源于骨髓或胚肝淋巴样干细胞分化发育的祖细胞。目前研究较多的是CD4 辅助性T细胞。根据表达的标志性细胞因子和转录因子的不同, CD4 辅助性T细胞主要分为以下几个亚型: Th1、Th2、Th17、Tfh、Th9、Th22 和Tr1[26]。PPARγ 在调节T细胞增殖和上述Th 细胞的分化中起着重要的作用[27]。PPARγ 激动剂吡格列酮(20 μmol·L-1) 显著抑制小鼠Naïve CD4+ T细胞向Th1、Th2和Th17细胞分化, 降低细胞上清中IFN-γ、IL-4、IL-13 和IL-17 的水平。与此报道一致, 新型TZD类似物TM17 显著降低RA患者外周血单核细胞(peripheral blood mononuclear cell, PBMC) 中IL-22、IFN-γ 和IL-17 水平[28]。此外, 据报道, 部分天然产物亦可作为PPARγ 激动剂通过抑制Th17 细胞分化发挥改善RA 的作用[29]。IFN-γ 的表达受到多种转录调控, 包括染色质重塑、DNA甲基化、T-bet、NFAT、NF-κB、STAT4、AP-1 和CREB/ATF。活化的PPARγ 可以通过与CREB 绑定蛋白(CREB binding protein, CBP)/p300 结合, 抑制AP-1 的活性, 从而降低IFN-γ 水平[30]。
与此报道一致, PPARγ 拮抗剂GW9662 促进T 细胞IFN-γ 表达。此外, IL-4 为Th2 细胞分泌的细胞因子, 可以促进T 细胞中PPARγ 的表达和单核细胞中12/15 脂氧合酶的表达。而12/15脂氧合酶可促使花生四烯酸转化成包括PPARγ 天然配体13-HODE 在内的多种代谢产物。13-HODE 可以被邻近的T 细胞摄取, 激活T 细胞中PPARγ。活化的PPARγ 可减少T 细胞分泌IFN-γ,抑制Th1 细胞分化[31]。此外, PPARγ 缺失使Th2 型细胞介导的免疫反应受损[32,33]。CD4+ T细胞中PPARγ 缺失, 使生长刺激表达基因2 蛋白(growth stimulation expressed gene 2, ST2)、IL-5和IL-13表达减少, 而PPARγ天然激动剂15d-PGJ2 和合成激动剂吡格列酮可以诱导ST2 表达[34]。基于转座酶和高通量测序的染色质分析技术和染色质免疫沉淀测序结果显示, 在Th2 细胞的开放染色质区域, PPARγ 存在多个关键的靶基因, 如AP1、Ets1、Runx1、Gata3、Stat5、IL5 和IL-13[33,35]。此外,PPARγ 通过抑制TGF-β/IL-6 诱导的RORγt 的表达选择性抑制Th17 细胞分化[36]。有趣的是, 研究表明PPARγ对Th17 细胞分化的抑制存在性别和种属差异。在人PBMCs 分离的CD4+ T细胞中, PPARγ 沉默增加IL-17A的表达。这种现象只出现在女性健康受试者T细胞中。
与此同时, PPARγ 的配体罗格列酮仅抑制女性受试者CD4+ T 细胞中IL-17A 的产生, 对男性受试者CD4+ T细胞上清中IL-17A 的水平没有显著影响[37]。而这种性别差异在小鼠中并未发现, 无论在雄性还是雌性小鼠CD4+ T 细胞中, PPARγ 激动剂均可抑制Th17 细胞分化[38]。此外, PPARγ对Tfh亦有影响, RA患者体内Tfh细胞增多, 促进B 细胞活化, 分泌大量自身抗体。
CD4-PPARγKO小鼠Bcl-6+CXCR5+ Tfh和GL-7+CD95+GCB 细胞数目与野生型小鼠相比明显增多; 吡格列酮(10 mg·kg-1) 腹腔注射连续6天显著降低小鼠脾脏Bcl-6+CXCR5+ Tfh 数目, 提示PPARγ 活化抑制Tfh 细胞产生[39]。
此外, B 淋巴细胞和树突状细胞(dendritic cell,DC) 与RA的发生发展关联亦十分密切。RA中B细胞功能和数目异常。在RA 患者中, 可以发现自身反应性B 细胞过度激活, 进而促进参与RA 发病机制的类风湿因子和抗瓜氨酸蛋白抗体的分泌及调节性B细胞数目减少, 造成免疫失耐受。据报道, B细胞PPARγ 特异性敲除小鼠与野生型小鼠相比, CD19+CDS+CD1dhiBreg 细胞和CD19+ B细胞IL-10 分泌明显减少, 凋亡数目增多, 而CD19+CD5+CD1dlow 细胞亚群IL-10 表达无显著差异; 提示PPARγ 敲除后小鼠免疫调节功能下降。此外, DC 是抗原提呈功能最强的抗原提呈细胞,其种类和功能具有多样性, 直接参与免疫应答过程, 从而直接参与RA的发病过程。据报道, 在DC分化过程中, PPARγ 影响共刺激分子CD80 和CD86 及DC 特征性标记物CD1a 的表达。PPARγ 激动剂降低LPS 或CD40 配体激活的DC中IL-12 的水平, 降低参与Th1 细胞募集的趋化因子IP-10 和RANTES 分泌, 降低共刺激分子CD86、CD83、CD80 和CD40 表达; 提示PPARγ抑制DC 成熟和降低DC 的免疫原性[40,41]。据报道, 在DC 的成熟过程中, p50、RelB、c-Rel、ERK1/2、JNK 和p38 MAPK 发挥着重要的作用; PPARγ 激动剂通过阻断NF-κB 和MAPK 信号通路抑制DC 成熟[42]。此外,DC中PPARγ 激活抑制EBI1 配体趋化因子和趋化因子受体CCR7 的表达, 抑制DC向淋巴结迁移[43]。罗格列酮处理的单核细胞来源的DC 中CD1d mRNA和蛋白表达增加(图2)。
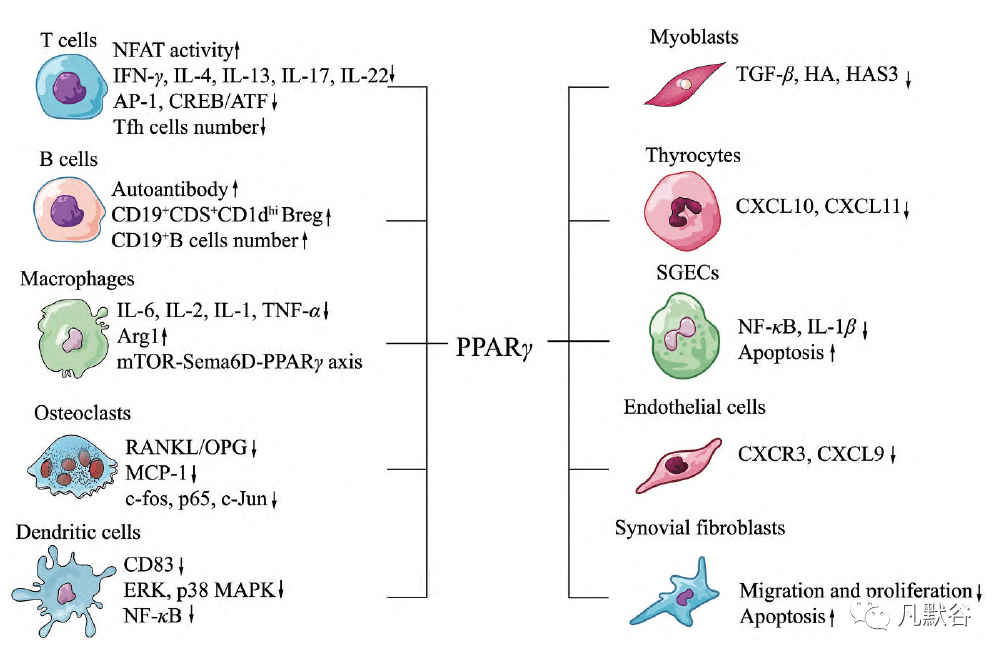
Figure 2 Protection of PPARγ involved in autoimmune diseases. PPARγ plays key roles in regulating activation and polarization of macrophages, function of dendritic cells, proliferation and differentiation of T cells, and modulation the function of related stromal cells including myoblasts, thyrocytes, salivary gland epithelial cells (SGECs), endothelial cells and synovial fibroblasts
3.2 PPARγ 与IBD
IBD 是一种异质性的胃肠道免疫紊乱的疾病, 主要包括2 种临床表型, 溃疡性结肠炎(ulcerative colitis,UC) 和克罗恩病(Crohn's disease, CD)。UC是一种主要累及结肠黏膜表面, 以连续的方式影响直肠的慢性疾病, CD则是以非连续的方式影响整个胃肠道并常伴有并发症(脓肿、瘘管和狭窄) 的疾病, 发病机制可能涉及遗传易感性、肠道免疫系统失调、环境因素、上皮细胞损坏和异常的黏膜免疫反应等多种因素。研究发现, PPARγ 参与IBD发病过程且在结肠组织中高表达。IBD 患者中TLR4 表达增加激活NF-κB和MAPK 信号通路使上皮细胞PPARγ 表达受损导致结肠炎症产生。与健康受试者相比, UC和CD患者结肠组织中PPARγ mRNA表达减少。研究表明, PPARγ激动剂抑制转录因子NF-κB 活化进而减少促炎因子TNF-α 和IL-6 产生; 以PPARγ 依赖的方式促进微生物清除及减少腹腔巨噬细胞活性氧产生进而改善IBD[44,45]。上皮细胞PPARγ特异性敲除小鼠更易被葡聚糖硫酸钠诱导, 表现出的炎症反应更强。
此外, PPARγ还可参与先天性免疫过程中抗菌响应, 调节结肠中β-防御素的表达, 如mDefB10和DEFB1。从PPARγ+/-小鼠的结肠黏膜中提取的阳离子肽对脆弱类杆菌、粪肠球菌和白色念珠菌的杀灭效果较从野生型小鼠的结肠黏膜中提取的阳离子肽弱, 表明PPARγ具有抗微生物作用[46]。PPARγ活化后促进结肠上皮细胞β 氧化过程限制肠道内含氧水平, 抑制病原性肠杆菌的扩增, 调控肠道稳态。
3.3 PPARγ 与SLE
吡格列酮(1 μmol·L -1 ) 显著抑制CD4+ T 细胞中T 细胞相关基因LCK、CD40LG、CD27、ITK、TXK、TP53 和FOXQ1 等表达[52]。此外, PPARγ 激动剂罗格列酮还可通过诱导脂联素产生减少SLE模型小鼠自身抗体的产生, 预防动脉粥样硬化和肾脏疾病[53]。罗格列酮联合地塞米松还能诱导SLE 患者的单核来源的DC向耐受表型分化[54]。
3.4 PPARγ 与MS
MS 是一种慢性中枢神经系统脱髓鞘的自身免疫性疾病, 其特征为中枢神经系统白质炎性脱髓鞘病变。由于自身反应性脑抗原特异性T细胞被激活而产生炎症性攻击, 引起轴突髓鞘破坏和神经功能破坏并伴随神经元死亡及硬化斑块的形成,逐渐导致肢体功能丧失[55]。MS 的发病机制不明, 遗传、感染和免疫因素可能参与其中。近年来, 关于PPARγ可作为MS 的治疗靶点的报道层出不穷。在多发性硬化脱髓鞘过程中, PPARγ 的表达水平显著下调[56,57]。
中枢神经系统PPARγ 缺失或PPARγ 拮抗剂则会进一步加重实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelit, EAE) 模型的临床症状。
此外, 多种信号转导通路及调节蛋白参与MS 的病理生理过程。Wnt/β-catenin 信号转导途径具有高度保守性, 可以与其他多种信号通路发生广泛的对话影响神经系统的功能, 此通路可能也参与了MS 的病理过程,其中β-catenin 蛋白是信号通路的关键调节点。而β-catenin 蛋白是PPARγ 的靶基因, PPARγ 激动剂发挥抑制MS 的机制可能为PPARγ 活化后经典的Wnt/β -catenin 信号途径被抑制, 最终导致少突胶质细胞前体细胞的增殖及分化功能抑制, 从而抑制MS[60]。据报道, 一些天然产物可以通过激活PPARγ 发挥改善MS的症状。如辣木籽素通过激活PPARγ 抑制β-catenin 信号通路及降低IL-1β 和COX-2 的表达从而抑制神经炎症, 显著改善小鼠EAE 症状[61]; 熊果酸可以通过激活PPARγ/CREB信号转导通路发挥促进少突胶质细胞分化和髓鞘形成及抗炎的双重作用改善MS[62]。
3.5 PPARγ 与SSc
PPARγ 能够在正常真皮成纤维细胞中表达, 抑制PPARγ 激活可以抑制肌成纤维细胞分化, 其机制可能为PPARγ 激活后抑制Smad 信号通路从而抑制TGF-β诱导的胶原mRNA 表达[67]。天然的PPARγ 配体15d-PGJ2, 可以减轻博莱霉素诱导的SSc 小鼠皮肤硬化, 降低结缔组织生长因子和TGF-β 的表达水平[68]。人工合成的PPARγ 激动剂2-氰基-3,12-二氧代齐墩果-1,9-二烯-28-酸可以减轻SSc 小鼠的皮肤炎症、抑制真皮纤维化和减少皮下脂肪萎缩[69]。
3.6 PPARγ 与其他自身免疫性疾病
SS 是一种以泪腺、颌下腺和唾液腺为主要损伤部位并累及全身外分泌腺功能异常的自身免疫性疾病。SS 在中国的患病率为0.29%~0.77%, 并呈上升趋势, 且90%以上为女性患者。该病以淋巴细胞浸润为主要特征, 表现为腺体分泌减少、眼、口干燥症状[70]。据报道, SS 患者唾液腺组织中PPARγ 的表达水平显著降低, 其表达水平与疾病严重程度成负相关[71]。动物实验研究表明, PPARγ激动剂罗格列酮(40 mg·kg -1 ) 每2 天给药一次, 连续给药8 周, 显著抑制SS 动物模型非肥胖型糖尿病(nonobese diabetes mellitus, NOD) 小鼠唇腺腺体破坏和单核细胞浸润, 降低NOD小鼠唇腺组织炎性因子mRNA的表达, 及促进Th2 型细胞因子分泌[72]。PPARγ 激动剂改善SS 的作用机制可能为: ① 抑制唾液腺上皮细胞p-p65 的核转位, 上调抑制性分子IκBα 水平进而抑制NF-κB信号通路; ② 抑制IL-1β 产生及抑制TLR3 诱导的细胞凋亡; ③ 减少TNF-α 诱导的唾液腺上皮细胞细胞间黏附分子1、死亡受体Fas/CD95、CD40 和HLAI产生[73]; ④ 促进AMPK 磷酸化上调脂联素来调节唾液腺上皮细胞的能量代谢, 改善内质网应激, 从而抑制上皮细胞凋亡[74]。
4
总结与展望
尽管, 目前研究尚不能清楚解释PPARγ 激动剂抑制AID的作用机制。但是越来越多的证据表明PPARγ这个靶点在AID的病理过程中的作用十分关键, 因此,以此为靶点研发AID 的治疗药物具有重要的科学意义。PPARγ 激动剂或许可作为AID标准治疗的辅助手段之一, 尤其是针对合并糖尿病、肥胖症或糖代谢紊乱的AID患者。
作者贡献
杨艳完成综述撰写和部分文献查阅; 周禹和隗雅姿完成部分文献查阅工作; 张天泰修改综述。
参考文献
详见 《药学学报》2022, 57(10): 3124 −3132
点击图片,查看详情
免责声明
本公众号发布的文章均为促进制药界同行的交流与学习;不用于任何商业用途。 我们尊重原创作品。选取的文章已明确注明来源和作者,版权归原作者所有,如涉及侵权或其他问题,请联系我们进行删除。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果, 注明【来源:凡默谷公众号】。
文章内容为作者观点,不代表本公众号立场。
文章搜索
本公众号开通往期文章任意搜功能啦
在公众号菜单栏中输入“搜索”,即可搜索往期微信内容
封面图片来源于:https://pixabay.com/zh/ 返回搜狐,查看更多
责任编辑: