怎么判断一个分子具有大π键以及大派键的类型?
3 个回答
\pi 键分为定域 \pi 键 (localized pi bond)和离域 \pi 键 (delocalized pi bond)。
大 \pi 键又称离域 \pi 键 (delocalized pi bond)。形成离域 \pi 键电子叫离域电子(delocalized electron)
二者区别如下

离域\pi 键,简单理解,指的是\pi 键可以出现在两个及以上的位置。如果\pi 键只能出现在固定的位置,则称为定域。

比如丙酮和 CO_3^{2-} ,其中丙酮的\pi 键不能出现在两个及以上的位置(因为没有空轨道可以接受电子),所以都是定域;而CO_3^{2-} 的一个\pi 键则可以出现在三个地方,所以是离域。
那么具体在什么情况下可以判断是离域呢?
首先,我们已经明确的是,离域电子需要有两个及以上的地方可以活动。具体来说,电子可活动的位置则是没有电子的空轨道。如果轨道已经满了,则电子不会进入;若轨道是半满,则添加的电子也会使分子形成稳定的结构,而非离域状态。离域状态的稳定性一定是要差于定域的
其次,活动范围必须要连续的

如图,如果中间卡了一个sp3的C,那在左上的两个离域电子是跳不到右下角的C的空轨道上的。因此,左上角的两个C中间的 \pi 键是定域的。
总结一下
需要有连续三个及以上的空轨道(通常来说是p轨道)才有形成离域 \pi 键的资格
接下来看类型。
离域 \pi 键的书写方式是 \prod_{a}^{b} ,b为离域电子数,a为参与成键p轨道数。
由于我们常见分子的离域情况都是连续的,因此,判断a的方式就是判断有几个中心原子。比如 CO_2 就是3, CO_3^{2-} 就是4。至于苯环,由于周边的H没有p轨道,因此不在a的计算范围内。而苯环的a就是6。
真正复杂的,或者困扰绝大多数人的是b的计算。我尝试用最常见的方式解释几种情况,之后附上一些其他答主的进一步思考吧。
回忆一下我们最初对\pi 键的认知:肩并肩。首先,为了形成\pi 键,一定是两个相互平行的轨道才能形成。在前文已经明确可形成空轨道的大多数是sp2或sp杂化的中心原子,根据VSEPR理论,sp2的空轨道垂直于sp2的平面,这些空轨道都是相互平行的。
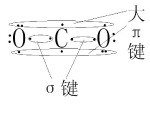
以二氧化碳为例(上面和下面两行的电子应该是相互垂直的,假设上面的是px轨道形成的键,而下面是pz轨道形成的键),px键中,C和右面的O在成键轨道的电子成对(也就是 \pi 键此时在右边),而左边的两个电子在非键轨道上(以孤对电子的形式存在);而在pz键中则是反过来,即\pi 键在左边,右边的两个电子以孤对电子的形式存在。因为二者可以同时存在(不在同一平面上),我们看到的则是有两个双键的 CO_2 。而对于每一个平面的离域 \pi 键,电子数则等于该平面上成键,非键和反键轨道上的电子的总和。(这里涉及的概念有点多,配合着下图的讲解,看完后可以再看一遍这段话)

综上,二氧化碳中离域 \pi 键数量为2,b的数量为4,a的数量为3。则其中有两个 \prod_{3}^{4}
通过以上的方法,我们也可以判断下面的几种情况:

到目前为止,对于一个高中生甚至是刚步入大学的学生而言,对于离域 \pi 键的理解已经足够了。
然而,通过计算机模拟,有很多分子,比如 NO_2 的离域 \pi 键类型就有所争议。因为根据我们的方法剖析,它还可以组成 \prod_{3}^{3} 的形式。而计算机给出的能量则趋于\prod_{3}^{3}和 \prod_{3}^{4} 之间。这就不是我们现在这种光靠表面的推理就能解决的问题了。
这里引用几个对离域 \pi 键的讲解比较清晰的回答
我先默认你知道pi键的定义
大pi键相比pi键,究竟大在哪里?
这个问题基本可以解释为,大在“该pi键由两个及以上原子的未杂化p轨道所形成”
与此同时有一些附加的说明:
- 即使只有两个原子,也可以写成Pi_m^n的形式
- 因为大pi键成因源自电子离域所带来的能量降低,能量降低原因来自电子填充于分子轨道后,其位于成键轨道的净电子数大于0,因此要求n(电子数)<2m(原子数)-1
- 形成大pi键的原子绝大多数情况是相连的(即前提是有一根sigma键),或链或环,或二者皆有。
- 广义的大pi键是指只要有未杂化轨道参与即可,因此p-p pi键、p-d pi键等同样成立。
常规判断方式
- 观察给出的结构简式或画出结构简式
- 判断各原子的杂化方式(一般为 sp^2 杂化,有 3 个杂化轨道)
- 画出杂化轨道形成的 \sigma 键,未形成 \sigma 键的孤电子对
- 画出各原子剩余的价电子,它们存在于未杂化的 p 轨道内,“肩并肩”重叠形成大 \pi 键
吡啶 \ce{C5H5N} 的结构分析:

- \ce{C} 原子和 \ce{N} 原子均为sp^2 杂化,分子空间结构为平面形
- 对 \ce{N} 原子分析:
- \ce{N} 原子最外层有5个价电子
- 3个杂化轨道中:2个用于形成\sigma键,1个用于形成孤电子对
- 还剩下1个价电子放在未杂化的 p 轨道内用以形成大 \pi 键
- 对 \ce{C} 原子分析:
- \ce{C} 原子最外层有4个价电子
- 3个杂化轨道中:全部3个用于形成 \sigma 键
- 还剩下1个价电子放在未杂化的 p 轨道内用以形成大 \pi 键
- 总计以上在未杂化的 p 轨道内的价电子一共6个,参与原子6个
- 所以,大 \pi 键键类型为: \prod^{6}_{6}
咪唑 \ce{C3H4N2} 的结构分析:

- \ce{C} 原子和 \ce{N} 原子均为 sp^2 杂化,分子空间结构为平面形
- 对 \ce{N^1} 原子分析:
- \ce{N} 原子最外层有5个价电子
- 3个杂化轨道中:3个用于形成 \sigma 键
- 还剩下2个价电子放在未杂化的 p 轨道内用以形成大 \pi 键
- 对 \ce{N^3} 原子分析:
- \ce{N} 原子最外层有5个价电子
- 3个杂化轨道中:2个用于形成 \sigma 键,1个用于形成孤电子对
- 还剩下1个价电子放在未杂化的 p 轨道内用以形成大 \pi 键
- 对 \ce{C} 原子分析:
- \ce{C} 原子最外层有4个价电子
- 3个杂化轨道中:全部3个用于形成\sigma 键
- 还剩下1个价电子放在未杂化的 p 轨道内用以形成大 \pi 键
- 总计以上在未杂化的 p 轨道内的价电子一共6个,参与原子5个
- 所以,大 \pi 键类型为: \prod^{6}_{5}
规律判断
- 对高中常见含有 大 $\pi$ 键 的分子或离子
三原子分子: \prod^{4}_{3}
\ce{CO2、NO2、NO^-2、NO^+2、SO2、O3、N2O、N^-3、NCO^-、SCN^-、CS2}
四原子分子: \prod^{6}_{4}
\ce{SO^{2-}3、BF3、CO^{2-}3、BO^{3-}3、NO^{3-}3}
考试中可以直接使用三原子即为 \prod^{4}_{3},四原子即为 \prod^{6}_{4} ,仅有例外: \ce{ClO2}\space\prod^{5}_{3}
更多内容:



